Actividad insecticida del aceite esencial de Ocimum sanctum var. cubensis en el control de Cochliomyia macellaria (Fabricius), en condiciones de laboratorio.
RESUMEN
El uso de insecticidas químicos sintéticos para el control de insectos es peligroso, afectan- do al hombre y los animales, contaminando el aire, el agua, el suelo y la cadena alimentaria, ocasionando graves efectos sobre la salud y propiciando el desarrollo de resistencia en varias especies de plagas y vectores. Todos estos problemas incrementan el interés por el desarrollo de insecticidas alternativos de menor impacto ambiental. Esta investigación se trazó como objetivo determinar el efecto insecticida del aceite esencial de Ocimum sanctum var. cubensis sobre la especie de moscas Cochliomyia macellaria (Fabricius). El aceite esencial fue extraído de las partes aéreas de la planta por el método de hidro-destilación en un equipo Clevenger. La colonia de dípteros muscoides fue mantenida según el procedimiento normalizado del Laboratorio de Entomología Médica y Forense del Instituto Oswaldo Cruz - LEMEF / FIOCRUZ. Para evaluar los efectos del aceite esencial sobre el desarrollo post-embrionario de las moscas, se ensayaron seis concentraciones (5, 10, 25, 50, 75 y 100%) en aplicación tópica 1μL/larva. Se obtuvo como resultado que en todos los tratamientos las larvas mostraron valores de masa corporal menores al compararlos con los grupos controles. El análisis de la duración de las etapas larval y pupal, así como del período de neolarva-adulto evidenció hubo un comportamiento que establece una diferencia entre los grupos tratados y los grupos controles. La utilización de este aceite esencial no influyó en la variable biológica razón sexual. Se concluye que el aceite esencial de Ocimum sanctum var. cubensis mostró actividad insecticida contra la especie Cochliomyia macellaria afectando los parámetros masa corporal y duración del período de neolarva-adulto, causando además mortalidad en todas las concentraciones probadas, por lo puede considerarse como un insecticida botánico de menor impacto ambiental para el control alternativo de esta especie de moscas
Palabras clave
Ocimum sanctum, albahaca, insecticida, Cochliomyia macellaria, impacto ambiental
ABSTRACT
The use of synthetic chemical insecticides for the control of insects is dangerous, affecting man and animals, contaminating the air, water, soil and the food chain, causing serious effects on health and promoting the development of resistance in several species of pests and vectors. All these problems increase the interest in the development of alternative insecticides with lower environmental impact. The objective of this investigation was to determine the insecticidal effect of the essential oil of Ocimum sanctum var. cubensis on the species of flies Cochliomyia macellaria (Fabricius). The essential oil was extracted from the aerial parts of the plant by the method of hydro-distillation in a Clevenger equipment. The colony of muscoid diptera was maintained according to the standard procedure of the Medical Entomology and Forensic Laboratory of the Oswaldo Cruz Institute - LEMEF / FIOCRUZ. To evaluate the effects of the essential oil on the post-embryonic development of the flies, six concentrations (5, 10, 25, 50, 75 and 100%) were tested in topical application 1μL / larva. The result was that in all the treatments the larvae showed lower body mass values when compared with the control groups. The analysis of the duration of the larval and pupal stages, as well as the period of neolarva-adult showed a behavior that establishes a difference between the treated groups and the control groups. The use of this essential oil did not influence the biological variable sexual reason. It is concluded that the essential oil of Ocimum sanctum var. cubensis showed insecticidal activity against the species Cochliomyia macellaria, affecting body mass parameters and duration of the neolarva-adult period, causing mortality at all tested concentrations, so it can be considered as a botanical insecticide with lower environmental impact for the alternative control of this species of flies.
keyword
Ocimum sanctum, basil, insecticide, Cochliomyia macellaria, environmental impact
Introduction
Los insecticidas químicos de origen sintético surgieron a mediados de la década de 1940. Los mismos actúan en el sistema nervioso de los insectos causando su muerte (Buss y Park-Brown 2006). Es el medio de control más utilizado para dípteros sinantrópicos, constituido principalmente por organoclorados y organofosforados (Vieira et al., 2001).
El uso de insecticidas químicos (sintéticos) para el control de insectos es peligroso, afectan- do al hombre y los animales, pudiendo contaminar el aire, el agua, el suelo y la cadena alimentaria (WHO, 1990; Environews Forum, 1999; Mendonça et al., 2011). Cusan también graves efectos sobre la salud, reportándose muertes y enfermedades crónicas en todo el mundo debido a la intoxicación por plaguicidas fundamentalmente en grupos de alto riesgo donde se incluyen trabajadores de producción, formuladores, pulverizadores, mezcladores, cargadores y trabajadores agrícolas. Son tóxicos tanto para animales vertebrados como para insectos polinizadores (Badii & Varela, 2008; Aktar et al., 2009; del Puerto et al., 2014; Benitez et al., 2018; Bernardino et al., 2019). Debido a la alta liposolubilidad que presentan, los compuestos clorados son biocumulativos, quedando retenidos en el tejido vivo (Ritter et al., 1995; FUNASA 2001; López et al., 2018). Se concentran en tejidos y fluidos animales con alta cantidad en la grasa como la carne, la leche y sus derivados (Klaassen y Rozmam 1991; Zaragoza-Bastida et al., 2016), pudiendo generar daños toxicológicos a la población humana y a los animales domésticos, tanto a corto y largo plazo (Eyer et al.,2004).
El uso excesivo de estos tipos de insecticidas también resultó en una progresiva resistencia de las plagas a esos químicos, disminuyendo su efectividad y generando consecuencias con potenciales negativos, como el aumento de la frecuencia de uso, de la dosis y de mezclas con compuestos más tóxicos (Hemingway y Ranson, 2000), perdieron su efectividad a medida que las poblaciones objetivo adquirieron resistencia genética contra sus compuestos (Gullan y Cranston, 2007). El desarrollo de resistencia en varias especies de plagas y vectores, con baja especificidad, aliado al negativo impacto ambiental, elevada toxicidad para vertebrados y el alto costo y eficiencia cuestionable de los insecticidas sintéticos de última generación, demostraron que el control de vectores con el uso exclusivo de ese producto el tipo de insecticida no garantizaba su eficiencia (García et al., 2017).
Todo lo expuesto hasta ahora incrementa el interés por los insecticidas alternativos (Almeida y Batista-Filho, 2001). Afortunadamente, el interés en desarrollar y usar productos botánicos para el manejo de plagas está aumentando (Isman, 1997; Mörner et al., 2002; Mathew, 2009). Este interés viene al encuentro de la necesidad de buscar métodos alternativos de menor impacto o riesgos para la salud humana y el medio ambiente, así como por la creciente demanda por productos alimenticios saludables y exentos de residuos de agrotóxicos.
Son innumerables las plantas poseedoras de poderes insecticidas, que deberían no sólo ser investigadas y ser utilizadas como modelos para síntesis de nuevos principios activos. Los conocimientos adquiridos con los mecanismos de defensa de las plantas han ayudado en el desarrollo de métodos de control de plagas menos agresivas al ambiente; muchos de estos principios activos tienen acción específica para algunos grupos de organismos, sin afectar a otros, y esta característica es importante para controlar sólo los organismos blancos. (Sobrino et al., 2016; Arias et al., 2017; Zurita et al., 2017; Molina et al., 2018; Flores-Villegas et al., 2019).
La especie Ocimum sanctum L. (OS) (syn. Ocimum tenuiflorum L.) es una planta muy utilizada para curar y prevenir enfermedades. Las especies de Ocimum son popularmente conocidas como albahacas (Pattanayak et al., 2010; Rashid et al., 2013). Esta planta tiene reportado efecto insecticida en varias especies de insectos (Obeng-Ofori y Reichmuth, 1997; Tawatsin et al., 2006).
Como respuesta a los factores negativos asociados al uso de insecticidas químicos sintéticos, la Organización Mundial de la Salud (OMS) ha sido alentada a buscar nuevas estrategias de control para vectores de agentes etiológicos causantes de enfermedades en humanos y animales domésticos y silvestres (Mörner et al., 2002). Entre estos vectores se encuentran diversas especies de moscas que parasitan humanos y animales de cría
causando irritación y llevando a pérdidas en la producción del ganado; son además capaces de generar enfermedades en ambos. Pueden ser vectores mecánicos de agentes patógenos del ganado, como Anaplasma marginale y Trypanosoma vivax (Peter et al., 2005). Las moscas son responsables también por causar o producir miiasis, una infestación por larvas de moscas en tejidos humanos o animal. Las miasis cutáneas incluyen enfermedades de la piel y daño del tejido subcutáneo causado por estas larvas y son comunes en países tropicales de las Américas del Sur y Central, así como en Sudáfrica, afectando principalmente al ganado y pastores, pero también pueden afectar a animales domésticos, individuos discapacitados, incapacitados, pacientes en estado avanzado de cáncer y personas que visitan áreas rurales donde habitan esas moscas. Los animales fuertemente infestados muestran una reducción significativa en el peso y la producción de leche, y sus pieles son dañadas por la perforación, de modo que pierden su valor comercial. (Zumpt 1965; Guimarães e Papavaro 1999; Sukontason et al. 2005). La especie Cochliomyia macellaria (Fabricius) (Diptera: Calliphoridae) puede producir miasis secundaria tanto en animales como en humanos. También por su comportamiento sinantrópico, se ha reportado que estas moscas son vectores mecánicos de enfermedades humanas y veterinarias. Esta especie es muy común en la América neotropical, desde el sur de Canadá hasta el norte de Argentina (Ferreira, 1983; Guimarães, 1983; Smith 1986; Litjens et al. 2001; Arteaga et al. 2012). Se considera como una de las principales especies de interés forense y sanitario en algunos países (Thomas y Ferrer, 2015).
Teniendo en cuenta estos antecedentes nos planteamos como objetivo de esta investigación: Determinar el efecto insecticida del aceite esencial de Ocimum sanctum var. cubensis sobre la especie de moscas Cochliomyia macellaria (Fabricius).
Materiales y métodos
Material Vegetal
Las hojas de Ocimum sanctum var. cubensis (albahaca mondonguera) fueron recolectadas en el mes de septiembre del año 2016 en el municipio San Luis provincia de Santiago de Cuba, Cuba. Las hojas fueron identificadas por taxonomistas especializados del "Centro Oriental de Ecosistemas y Biodiversidad (BIOECO)" del Museo de Historia Natural "Tomás Romay" de la Ciudad de Santiago de Cuba. Este material seco también fue depositado en el herbario de esta institución bajo el número de registro 3247.
Obtención y caracterización del aceite esencial
La extracción del aceite se realizó usando el equipo Clevenger y utilizando la técnica de hidro-destilación fueron removidos los aceites esenciales de las partes aéreas (hojas esencialmente) de cada una de las plantas. Después de la conclusión del proceso de extracción del aceite, que fue almacenado a 4 ° C en un frasco ámbar y al abrigo de la luz.
Creación y mantenimiento en el laboratorio de las colonias de dípteros muscoides
La colonia de dípteros muscoides incluidos en el estudio fue establecida a partir de adultos recogidos en el Campus de la Universidad Federal de Amapá – UNIFAP. La metodología utilizada para el establecimiento y mantenimiento de las colonias fue la establecida por Queiroz y Milward-de-Azevedo (1991), que consiste en mantener a los adultos en jaulas de madera, con pantallas de nilón en las laterales y una abertura frontal que contiene una manguera de tejido negro para el manejo de los insectos, el volumen de la jaula es de aproximadamente 2,7 m3 (30x30x30 cm).
Esta misma metodología preconiza una alimentación a base de sacarosa ofrecida en forma de azúcar refinado que se dispone en una solución en forma de jarabe simple a una concentración de 83 ± 2% y agua provista en botellas con una mecha de gasa para difusión por cohesión.
Los dípteros utilizados fueron provenientes de nuevas colonias, hechas a partir de la primera generación de los adultos recolectados. Para el sustrato de postura y maduración de las hembras de la especie C. macellaria se ofreció carne molida putrefacta, dieta establecida en el Laboratorio de Entomología Médica y Forense del Instituto Oswaldo Cruz - LEMEF / FIOCRUZ.
Bioensayo de actividad insecticida en dípteros muscoides
Después de aproximadamente 12 horas de inducida la postura con carne bovina putrefacta se obtuvieron cantidades suficientes de larvas en instar L1 para probar seis dosis (cuatro repeticiones con 50 larvas cada una) totalizando 1600 larvas en total. Las concentraciones se prepararon utilizando sulfóxido de dimetilo (DMSO) como disolvente (5, 10, 25, 50, 75 y 100% de aceite esencial). Dos grupos se utilizaron como control; en uno de ellos sólo DMSO fue agregado, y en el otro, ninguna sustancia fue agregada (control puro), siendo la aplicación hecha inmediatamente después de la dilución.
Se aplicaron 50μL de cada concentración de aceite tópicamente sobre 50 larvas recién eclosionadas a una relación de 1μL / larva aproximadamente. Después de la aplicación las larvas fueron transferidas a un contenedor conteniendo 50g de dieta y este recipiente fue acondicionado dentro de un segundo recipiente de mayor volumen, conteniendo vermiculita como sustrato de pupación. Estos fueron cubiertos por tejido de nilón (escaline) atrapado por elástico.
En todos los tratamientos, las pupas fueron recolectadas, pesadas en balanza de precisión y acondicionadas tres por cada tubo de ensayo, conteniendo hasta ¼ de su volumen de vermiculita y tapados con escaline, para la pupación y posterior emergencia de los adultos. Las observaciones se registraron en una planilla adecuada para el desarrollo de los dípteros diseñada en el Laboratorio de Entomología Médica y Forense.
Se calculó la viabilidad larval mediante la siguiente fórmula:

En el momento de la emergencia de los adultos se calculó la viabilidad pupal y en conjunto, la viabilidad de neolarva a adulto utilizando las siguientes fórmulas respectivamente:

Los insectos fueron observados en cuanto a la viabilidad del desarrollo de las fases de larva, pupa y neolarva a adulto, duración de cada fase y razón sexual calculada según la siguiente fórmula:

La mortalidad absoluta (aquellos individuos que no emergieron) fue calculada a través de la inversión de la viabilidad. La mortalidad fue corregida usando la fórmula de Abbott (1925).

Obtención, registro y análisis estadístico de los datos
Los resultados de la actividad insecticida sobre el desarrollo post embrionario se analizan a través del análisis de varianza (ANOVA: P ≤ 0,05). Se utilizó la Prueba de Comparación Múltiple de Medias de Tukey para análisis de la significancia estadística, y la desviación estándar fue calculada a través del promedio de los experimentos. Se utilizó el paquete estadístico Graphpad® Prism para realizar estos cálculos estadísticos.
Resultados
Efectos del tratamiento con el aceite esencial de Ocimum sanctum var. cubensis sobre el desarrollo post-embrionario de Cochliomyia macellaria.
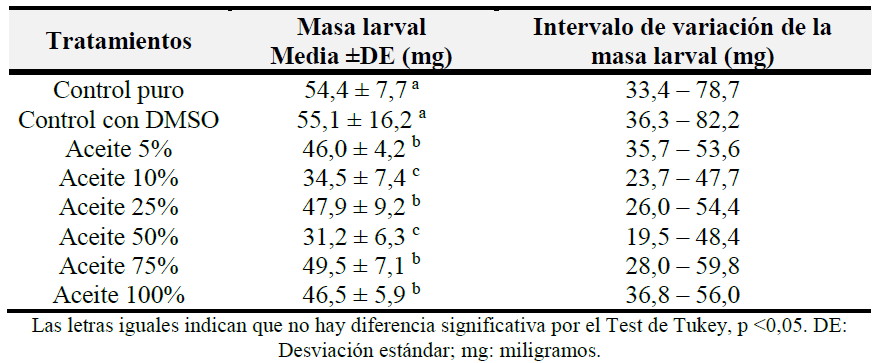
Los valores determinados de masa corporal de las larvas maduras de C. macellaria al abandonar la dieta para pupar están representados en la Tabla I. Se observó que sólo los grupos controles no presentaron diferencias estadísticamente significativas entre ellos, una vez aplicado la prueba de comparación múltiple de promedios de Tukey (p <0,01). En general, todos los tratamientos mostraron valores de masa corporal menores al compararlos con el grupo control.
Tabla I. Efecto sobre la masa corporal de las larvas de Cochliomyia macellaria después del tratamiento con el aceite esencial de Ocimum sanctum var. cubensis.
El análisis de la duración de las etapas larval y pupal, así como del período de neolarva - adulto evidenció que en la etapa larval hubo un comportamiento que establece una diferencia entre los grupos tratados y los grupos controles (Figura 1).
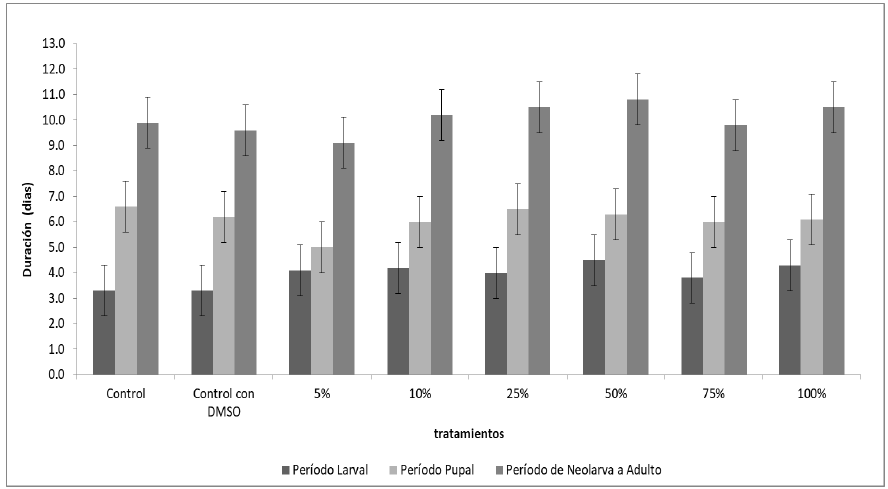
Figura 1. Efecto del aceite esencial de Ocimum sanctum var. cubensis sobre el tiempo de desarrollo de Cochliomyia macellaria.
En este período se observó que existen diferencias estadísticamente significativas para todas las concentraciones cuando se aplica la prueba de Tukey (p <0,01). Siendo mayores el período de desarrollo larval (4-5 días) para los grupos tratados al compararlos con los grupos controles (3-4 días).
En el estadio pupal el comportamiento presentó también diferencias, el control puro presenta diferencias estadísticas con todos los grupos tratados, siendo mayor el período promedio de desarrollo en comparación con los tratamientos, siendo este período entre 6-7 días para el control puro y entre 5- 7 días para los grupos tratados.
Al analizar el período completo de neolarva a adulto, se observó que todos los grupos tratados, diferían estadísticamente de forma significativa al ser comparados con el grupo control puro después de realizar la prueba de Tukey (p <0,01). El grupo tratado con el aceite al 5% presentó un valor medio menor que el grupo control puro, y los otros grupos tratados presentaron valores medios mayores lo que demuestra la influencia de este aceite en el desarrollo de esta especie de mosca.
En relación al parámetro de razón sexual, no se encontró ninguna diferencia estadística, de acuerdo con la prueba del chi-cuadrado. De esta forma se puede concluir que la utilización de este aceite esencial no influye en esta variable biológica (Figura 2).
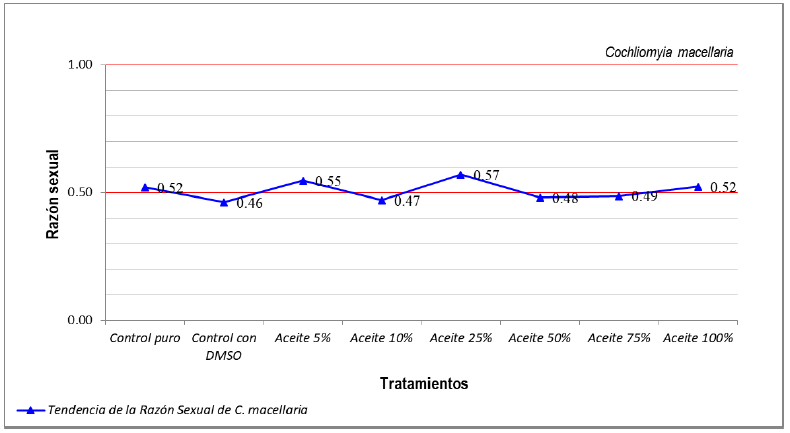
Figura 2. Razón sexual de Cochliomyia macellaria después del tratamiento con el aceite esencial de Ocimum sanctum var. cubensis.
Se observaron efectos de mortalidad con la aplicación del aceite de O. sanctum en todas las concentraciones evaluadas, no observándose relación dosis/efecto (Figura 3).
En todos los casos se obtienen valores de mortalidad corregidos superiores al 39% cuando se analizó el período de neolarva hasta adulto. Los grupos con mayores concentraciones de aceite esencial no siempre fueron más eficaces que los grupos con menores concentraciones. Las mayores mortalidades fueron para el 5% (62%), el 50% (61%), el 25% (57, 8%) y el 100% (50,8%).
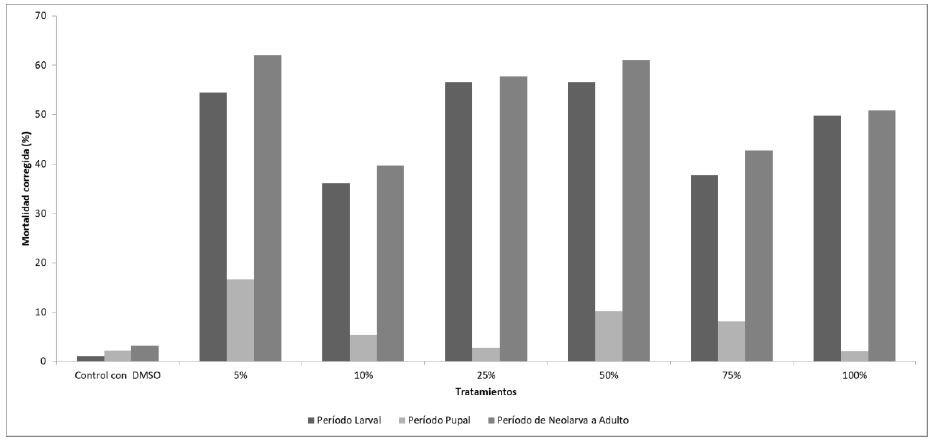
Figura 3. Mortalidad corregida larval, pupal y del período de neolarva-adulto de Cochliomyia macellaria después del tratamiento con el aceite esencial de Ocimum sanctum var. cubensis.
Discusión
En un estudio realizado con larvas de la especie C. macellaria, los investigadores Cunha-e-Silva y Milward–de-Azevedo (1994), obtuvieron un peso medio para estas larvas de 0,056 g, peso muy parecido al obtenido en el presente trabajo para las larvas de los grupos controles, lo que sugiere la influencia del aceite en la reducción del peso de las larvas tratadas. Algunos autores se refieren a la acción tóxica, repelente y / o antialimentaria de los extractos obtenidos de plantas, que puede deberse a que actúan como insecticida, que en el sentido de la propia palabra, causan la muerte del insecto por intoxicación, y pueden actuar también como antialimentario o sea inhibiendo al insecto a iniciar la alimentación (Kathrina y Antonio 2004; Arias et al., 2017).
Como ya habíamos planteado el período de desarrollo larval fue mayor para los grupos tratados con el aceite esencial de O sanctum que para los grupos controles. Este comportamiento puede estar relacionado con el hecho de que las larvas tratadas con el aceite esencial fueron más leves, o sea que la sustancia aplicada de alguna forma influenció la poca asimilación de nutrientes por las larvas lo que provocó una demora mayor para pasar al estadio de pupa. Es importante resaltar que la nutrición larval ejerce una fuerte influencia sobre el tamaño de los adultos, existiendo una correlación directa entre el tamaño del adulto y la tasa de oviposición (Thomas, 1993). Este tiempo de desarrollo larval obtenido para los grupos controles es similar al observado por Silva et al. (2012) para esta especie de moscas cuando determinaron un período larval promedio de 4,17 ± 0,13 días.
En el estadio pupal el comportamiento presentó también diferencias, el control puro presenta diferencias estadísticas con todos los grupos tratados, siendo mayor el período promedio de desarrollo en comparación con los tratamientos. Algunos insecticidas botánicos pueden actuar en el sistema neuroendocrino, interfiriendo en los procesos normales de metamorfosis, siendo denominados de reguladores de crecimiento (Kathrina y Antonio, 2004).
Cuando se comparó este resultado con los que aparecen en la literatura, fue posible constatar que el comportamiento irregular evidenciado en la duración de la etapa larval ya fue evidenciado por otros autores, como por ejemplo, Khater y Khater (2009) al evaluar la actividad insecticida de cuatro plantas medicinales contra L. sericata (Diptera: Calliphoridae), concluyendo estos autores que algunos extractos de plantas pueden causar anomalías en larvas y pupas, asociando este comportamiento a posibles disturbios ocasionados en el sistema endocrino que podría interferir en los procesos fisiológicos ligados a la metamorfosis.
De acuerdo con D'Almeida et al. (2001), cuando se trata de la eficacia de sustancias o compuestos sobre individuos estudiados, los mejores parámetros a ser considerados, son la duración y la viabilidad (inverso de la mortalidad) del período de neolarva a adulto, pues los períodos larva y pupal son más influenciados por factores abióticos como temperatura, fotoperíodo y humedad relativa. También se debe considerar que a menudo ocurre una baja mortalidad en el período pupal, que puede ser explicado por el hecho de que ese período se caracteriza por grandes cambios internos y poca influencia de factores externos al metabolismo (Needham, 1929).
Al analizar el período completo de neolarva a adulto, se observó que todos los grupos tratados, diferían estadísticamente al compararlos con el grupo control puro. En todos los casos se obtuvo un período mayor de desarrollo que el obtenido por Silva et al. (2012) que observaron que el período total de desarrollo de C. macellaria, criadas en dieta de carne bovina en condiciones controladas (30ºC día/28ºC noche, 70 ± 10% UR y 12h de fotoperiodo) fue de 8,16 ± 0,054 días, lo que puede indicar que el aceite esencial de O. sanctum puede actuar como un regulador de crecimiento en esta especie.
Todos los grupos tratados tuvieron un comportamiento estable, con valores de razón sexual cercanos a 0,5 y en la misma franja que el grupo control según lo establecido por Fisher (1930). Estos resultados corroboran el estudio realizado por Cunha e Silva et al. (2010) al probar el extracto etanoico del tallo de C. linearifolius en la especie C. macellaria en el cual no obervaron variaciones en los índices de razón sexual (Control: 1,52 / 1, 20mg / ml: 1,2 / 1, 40mg / mL: 1,03 / 1 y 60mg / ml: 1 / 1,15) en ninguna de las concentraciones en comparación con el grupo control. El mismo resultado que fue hallado por Dutok (2015) al evaluar el comportamiento de la razón sexual de esta especie después del tratamiento con el extracto acuoso bruto de semillas de Pouteria mammosa.
En todas los concentraciones evaluadas se obtienen valores notables de mortalidad aunque está mortalidad fue independiente de la dosis de aceite empleada. Existe la posibilidad de explicar este comportamiento por un posible efecto del DMSO, sustancia usada como solvente. Notman et al. (2006) reportaron que el DMSO es capaz de inducir poros en la membrana, así como Andrey et al. (2007) indican que esta sustancia puede desbastar la expansión de una bicapa de fosfolípidos aumentando su fluidez. Este núcleo hidrofóbico puede explicar por qué el DMSO promueve la permeación de solutos, particularmente en entidades hidrofóbicas, hecho este que pudo aumentar la entrada del aceite al interior de las larvas independientemente de la concentración evaluada.
A pesar de cualquier explicación teórica, el aceite esencial en todas las concentraciones probadas la probó ser eficaz contra el desarrollo de la mosca Cochliomyia macellaria que es una de las principales especies causantes de miasis cutáneas secundarias en animales y personas.
Conclusions
El aceite esencial de Ocimum sanctum var. cubensis mostró actividad insecticida contra la especie Cochliomyia macellaria afectando los parámetros masa corporal y duración del período de neolarva-adulto, causando además mortalidad en todas las concentraciones probadas, por lo puede considerarse como un insecticida botánico de menor impacto ambiental para el control alternativo de esta especie de moscas.
